供科幻百合小说作者参考
以下假设相关研究都没有造假或者其它猫腻
根本问题
有胎盘的哺乳动物因为genomic imprinting的存在,无法像其它某些纲的脊椎动物(比如这种蜥蜴,全员雌性,雌性和雌性之间通过互相假交配刺激排卵,画面太美)一样进行孤雌生殖。简单地说,因为imprinting,有些基因只在父亲来源的基因组中表达(第一类),有些基因只在母亲来源的基因组中表达(第二类),如果一个双倍体基因组都是父源的,那么第一类基因的表达就会过量而第二类基因的表达就会缺失,如果一个双倍体基因组都是母源的,那么第一类基因的表达就会缺失而第二类基因的表达就会过量。这两种情况都是致命的,只有第一类基因和第二类基因的表达量(剂量)都合适的时候,双倍体个体才有正常的表现型。
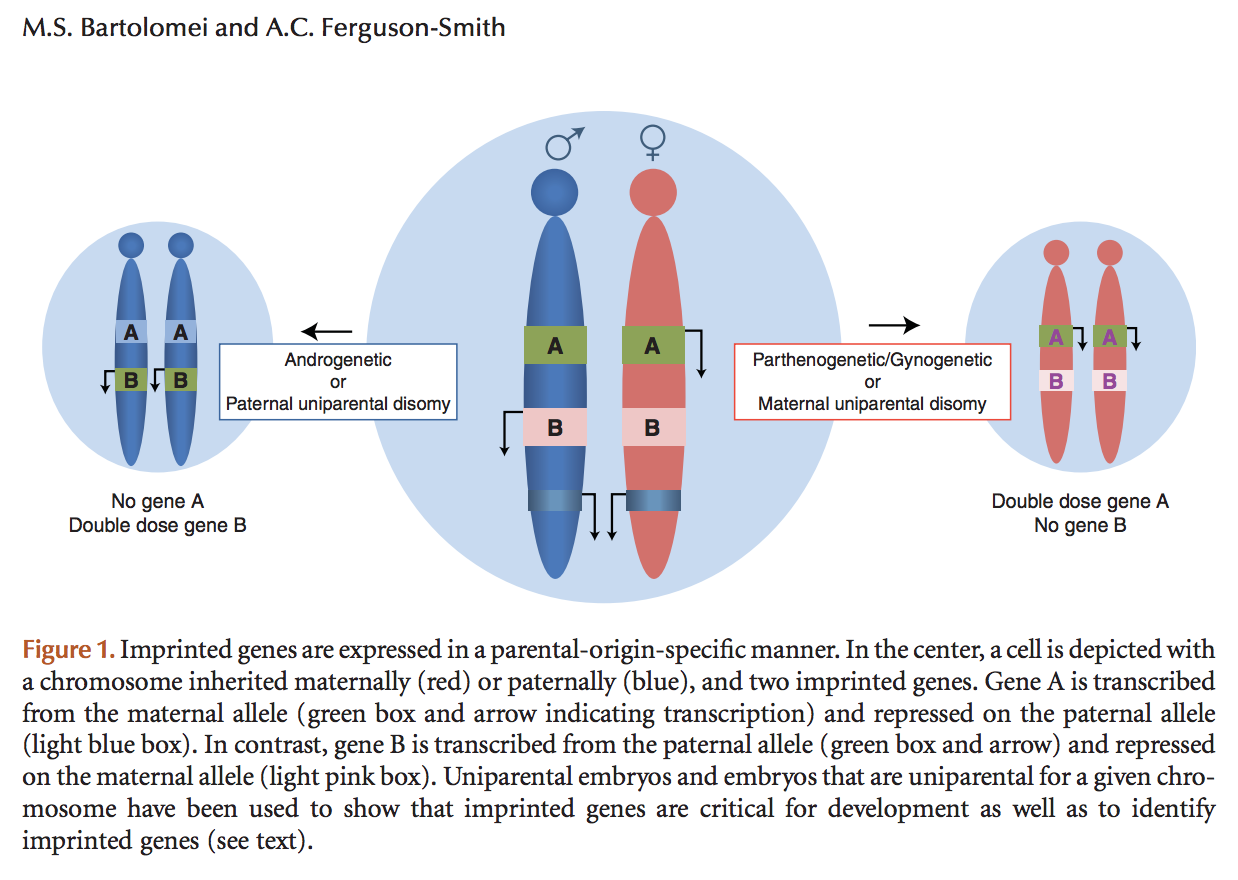
imprinting与基因表达剂量。图片来源:Cold Spring Harb Perspect Biol 2011;3:a002592
那么显然地,如果要实现女女生子,就得想办法让前面说的第一类基因和第二类基因在基因组全是雌性来源的动物中表达量正常,即得到一份雌性来源但imprinting状况和精子基因组相仿的单倍体基因组。
技术回顾
怎样得到imprinting状况类似精子基因组的、雌性来源的单倍体基因组呢?通过reprogramming来改变epigenetic修饰比较麻烦,于是最简单的思路就是弄一份没有imprints(完整时既表达本来限定母源表达的基因,又表达本来限定父源表达的基因)、但删掉仅限定母源表达的基因的单倍体基因组。
怎样得到没有imprints的单倍体基因组?
有两种办法。
第一种办法利用了哺乳动物imprinting周期。哺乳动物的生殖细胞发育早期(还是胎儿时),从父母那里遗传来的imprints会被擦除。这是因为减数分裂中,分到配子中的染色体的来源是混合的,有的是父源的,有的是母源的,只有先擦除再重建,才能让配子的imprinting状态和动物的性别继续保持一致。雌性幼体的停滞在第一次减数分裂双线期的未发育卵母细胞,就是已经擦除掉旧imprints、尚未没有建立新imprints的生殖细胞,可以利用。
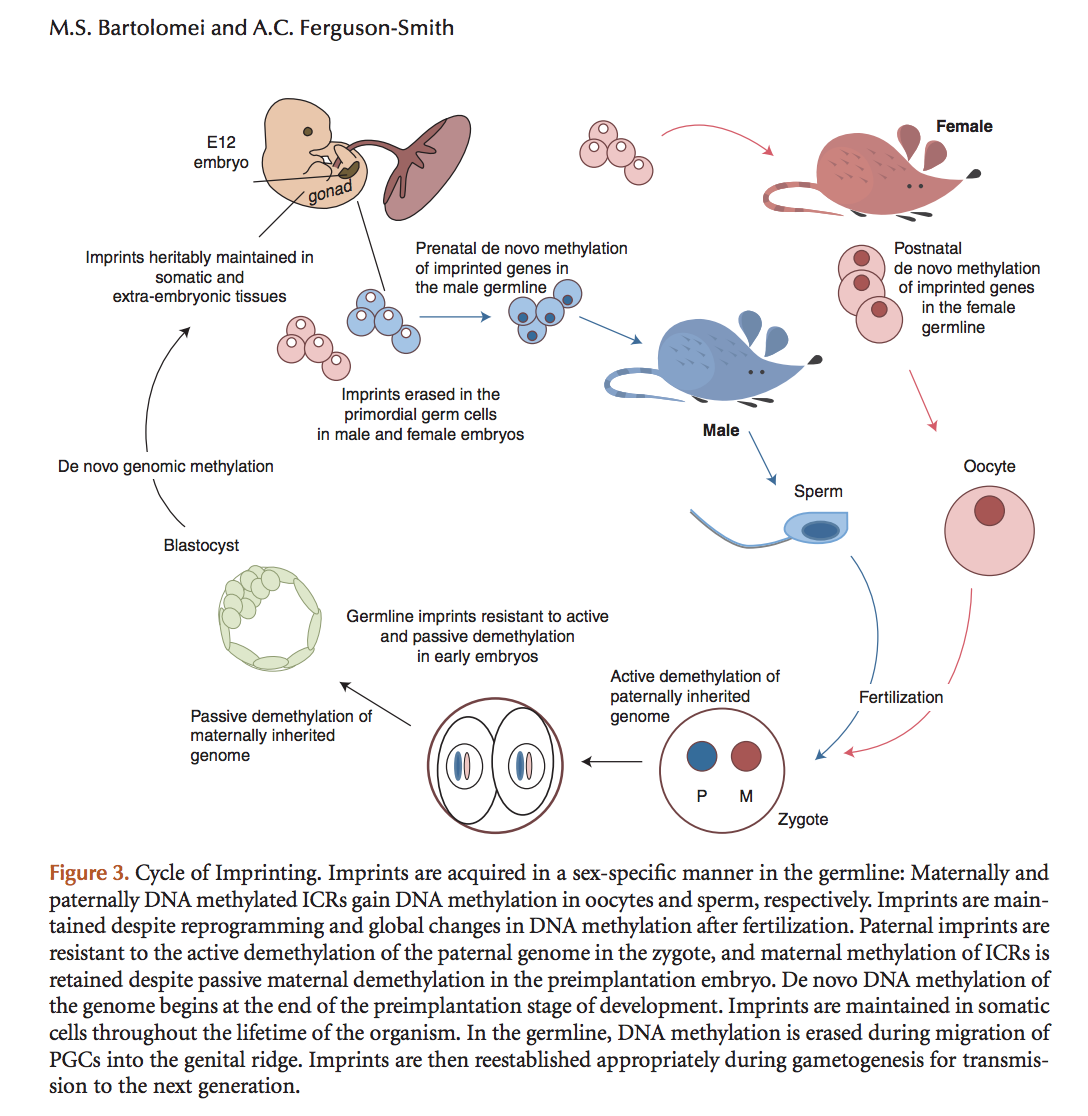
哺乳动物imprinting周期。图片来源:Cold Spring Harb Perspect Biol 2011;3:a002592
第二种办法,是利用实验手段让本来已经完成imprinting的基因组去掉imprints。干细胞研究人士发现,实验室里养的干细胞的imprinting状态是不太稳定的,养着养着可能imprints就不见了。这类现象,对想做器官再生的人是很讨厌的,是一种安全隐患,但却刚好可以用来获取没有imprints的基因组。之前有人已经做了遗传材料都是雌性来源的单倍体的干细胞(parthenogenetic haploid ESC, phaESC),这种干细胞养一养就会脱去母源imprints,开始表达原来只在父源基因组里表达的那些基因。
光得到没有imprints的单倍体基因组还不够,因为实现女女生子还需要在这样的基因组里删除掉那些仅在母源基因组里表达的基因。否则,直接把这样的单倍体基因组和普通的雌性来源单倍体基因组结合,得到的结果是仅在父源基因组里表达的那类基因表达量正常,但仅在母源基因组里表达的那类基因表达量过量(正常+过量的组合)。比直接什么都不做就直接结合两个雌性来源单倍体基因组(缺失+过量的组合)强一点,但是仍然不足以得到健康的后代。
删除又有两种办法。第一种是做缺失仅在母源基因组里表达的基因的敲除动物,然后从这种动物身上获取没有imprinting的单倍体基因组。另一种就是在体外培养的细胞系里通过基因编辑做敲除。
利用前面说的思路,现有的成功的雌性X雌性生子的实验,比较知名的,一个是日本人的Kaguya(思路是取删掉13kb H19的小雌鼠的未成熟卵细胞和野生型雌鼠的卵细胞融合)系列研究,一个是中科院动物所的人搞的一系列(如这个,这个)使用基因编辑过(删除几个母源表达only的基因如H19,Rasgrf1)的脱imprints的phaESC充当“精子”的研究。均能以较低的成功率(按生出来的足月的表型接近野生型的小鼠的数量和植入胚胎数量的比看)产生可以自然交配生育、看上去表型基本正常的雌性小鼠。
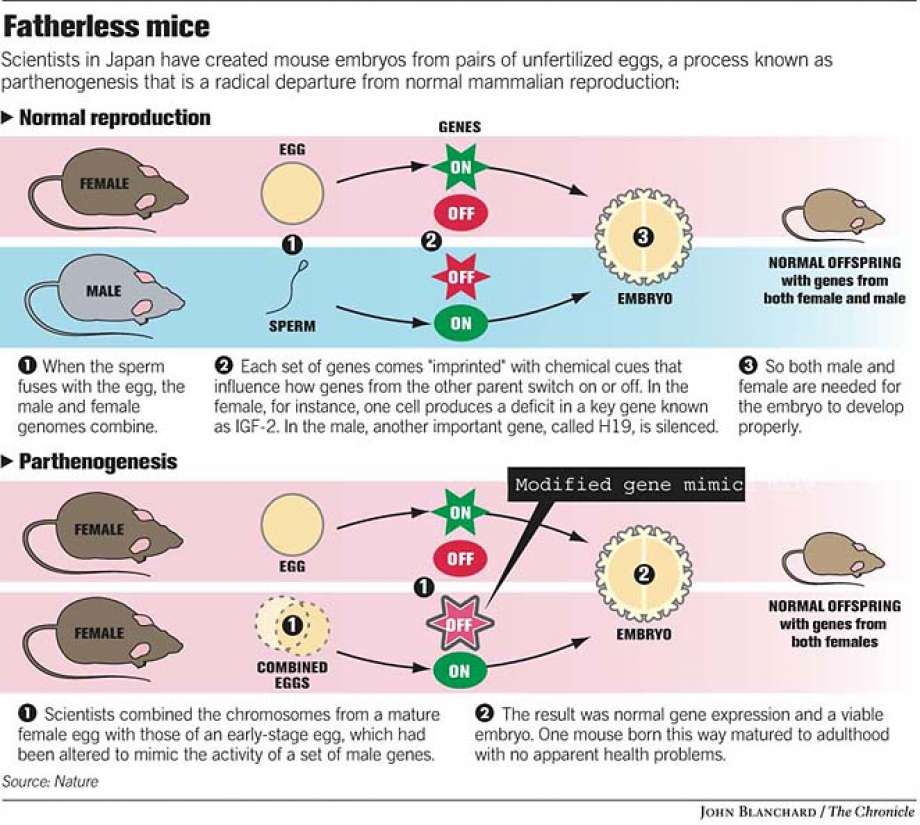
kaguya原理。图片来源:https://www.sfgate.com/news/article/Look-Moms-no-dad-Mice-born-in-Japan-from-2789992.php
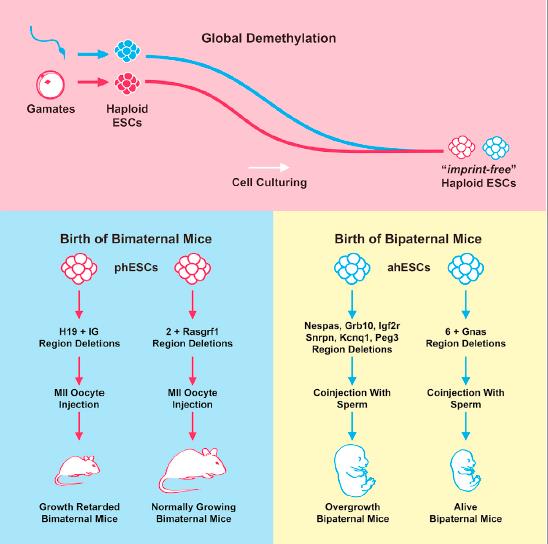
用单倍体干细胞实现雌性X雌性生子(左边)。图片来源:http://dx.doi.org/10.1016/j.stem.2018.09.004
伦理问题
很明显,按上述思路,目前人类女女生子直接产生(不说性别比控制之类的间接产生的问题)的伦理问题比普通的基因编辑婴儿大,失败率问题,“失败品”处置问题,安全性问题,人体小白鼠问题,这种就不说了,一般的基因编辑会有的伦理问题,女女生子都有,因为基因编辑是实验的一个必须步骤。
Kaguya的思路,因为用到删除了某些基因片段的雌性动物的未成熟卵细胞,明显在人类身上不可用,因为这需要先制造出一个存活成问题的女胎/女婴来取卵。一个可能的解决方法是在体外用干细胞培养卵巢然后取未成熟卵,但目前没有见到有人这么做。
用phaESC的思路,虽然不需要先做基因删除女婴,但是即使成功,由于充当“精子”的那部分基因组是做了删除的,存活个体的一半染色体是缺失限定母源表达的那部分基因的。这意味着,用这种方法产生的女性日后如果自然生育,当受精的卵子包含的是被编辑过的染色体时,由于缺失限定母源表达的基因,后代是无法存活或者有严重缺陷的,类似于Prader-Willi综合征祖母遗传给孙辈的情况。于是必须做试管婴儿才能保证没问题。
如果要避免女女生子产生的后代的这种生育问题,就需要在维持genomic integrity,不搞删除的情况下模拟出精子imprinting特征的技术了。目前没看到。
值得注意的是,kaguya和中科院动物所的人做出来的雌雌生子小鼠,虽然表型看上去基本正常,但研究人员其实是不知道这些小鼠的认知能力是否完全正常的,因为小鼠不会说人话,人类用实验检测小鼠的一些微妙行为异常总是很困难的(这是人类精神疾病的小鼠模型充满争议的原因之一)。换句话说,就算那些看上去正常的小鼠头脑有轻微的问题,人类研究者是很难发现的。但这样的轻微缺陷放到人身上可能就是不可接受的了。
另外,在小鼠上做的人并没有试图修改所有的限定母源表达的基因,只“抓了主要矛盾”,就取得了“看上去正常”的效果,但这在人身上是否行得通是有疑问的。人类的涉及imprinting的遗传病有上百种,说明人类的imprinting错一点就有严重后果。这意味着如果在人身上做,需要修改的基因比做出一个在人类研究者眼里貌似正常的小鼠所需要修改的基因的数量多得多。
由于小鼠和人类存在imprinting的基因差异较大,小鼠对于测试人类女女生子技术,可能不是一个很好的动物模型。而使用灵长类,周期长,成本高,动物保护方面的争议也更大。没有合适的动物模型,就不可能走得太快太远。
总结
从相关技术现状看,在人类身上成功实现,还比较遥远